 Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) объявило о выборе девяти компаний для участия в его добровольной пилотной программе Pre-Cert. Эта программа призвана стимулировать инновации путем создания менее ограничительной нормативной базы, которая приведет к более быстрому принятию программного обеспечения, связанного со здоровьем, а в некоторых случаях — и других продуктов.
Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) объявило о выборе девяти компаний для участия в его добровольной пилотной программе Pre-Cert. Эта программа призвана стимулировать инновации путем создания менее ограничительной нормативной базы, которая приведет к более быстрому принятию программного обеспечения, связанного со здоровьем, а в некоторых случаях — и других продуктов.
Среди компаний, принятых в программу, — Apple, Fitbit, Johnson & Johnson, Pear Therapeutics, Phosphorus, Roche, Samsung, Tidepool и Verily.
С помощью этой программы FDA стремится создать более индивидуальный подход к цифровым медицинским технологиям, оценивая разработчика программного обеспечения, а не сам продукт, для создания программы предварительной сертификации на уровне компании для этих цифровых медицинских инструментов. Компании, принятые в программу, будут проверяться на предмет разработки, валидации и обслуживания программного обеспечения, чтобы определить, соответствуют ли они стандартам качества FDA для предварительной сертификации.
Компании, прошедшие предварительную сертификацию, могут подавать меньше информации в FDA перед выводом на рынок нового цифрового медицинского инструмента, что ускорит одобрение новых услуг и технологий. FDA также рассматривает возможность разрешения предварительно сертифицированным компаниям в некоторых случаях избегать представления продуктов для допродажной проверки.
В рамках программы Apple предоставит FDA доступ к мерам, которые она использует для разработки, тестирования и обслуживания программных продуктов. Apple согласилась разрешить посещение сотрудниками FDA и предоставить информацию о своей системе управления качеством.
«Наш метод регулирования цифровых медицинских продуктов должен учитывать уникальные и итеративные характеристики этих продуктов, — заявил доктор Готтлиб. — Нам необходимо модернизировать нашу нормативную базу, чтобы она соответствовала типу инноваций, которые нам предстоит оценивать, и способствовала развитию полезных технологий, одновременно гарантируя потребителям доступ к высококачественным, безопасным и эффективным цифровым медицинским устройствам. Эти участники пилотной программы помогут агентству сформировать лучший и более гибкий подход к цифровым медицинским технологиям, который фокусируется на разработчике программного обеспечения, а не на отдельном продукте».
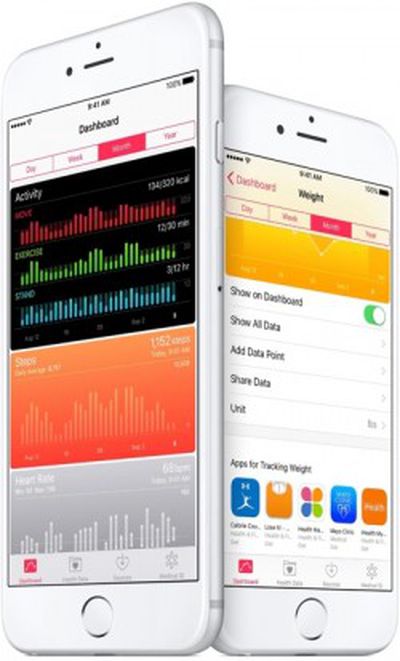
Для Apple эта программа может стать значительным преимуществом, поскольку у компании есть ряд цифровых медицинских инструментов, таких как Health, CareKit и ResearchKit, и одобрение FDA, вероятно, является одним из основных препятствий для выпуска новых продуктов, связанных со здоровьем, над которыми, по слухам, ведется работа, например, устройство для мониторинга уровня глюкозы в крови.
Генеральный директор Apple Тим Кук заявил, что Apple не хочет подвергать Apple Watch процессу одобрения FDA, но если программа пройдет успешно, Apple также может столкнуться с меньшим количеством ограничений, когда речь идет о будущем Apple Watch, что может позволить реализовать новые, более продвинутые возможности мониторинга здоровья.